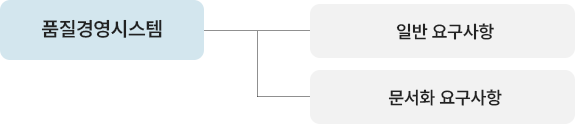
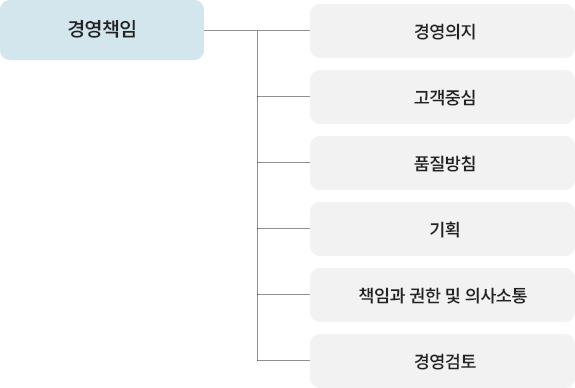
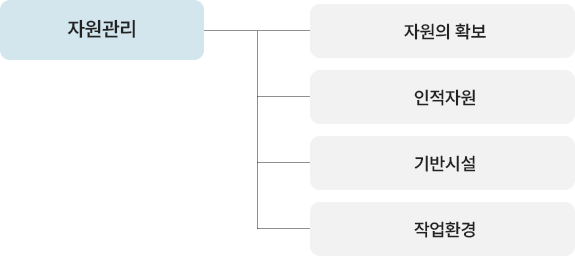
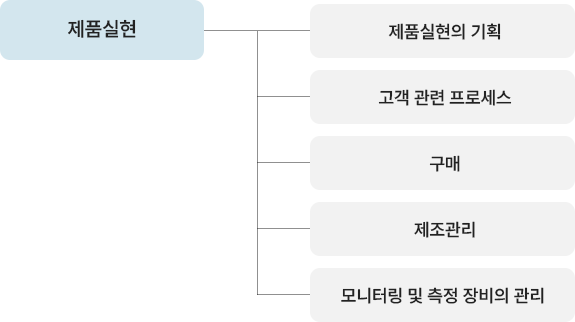
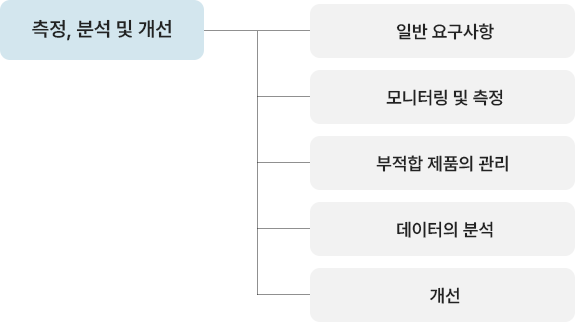
| 컨설팅 사전준비 | 컨설팅 안내 | 컨설팅 전반내용 설명(기간/비용/지도방법 등) |
| 고객 요구사항 파악/협의 | 고객의 요구내용/수준, 방향, 일정, 비용 등등 |
| 회사현황 파악 및 초기 진단 | 현장투어/관련규정/조직도/제품현황/품질관리팀장 인터뷰 등 확인 |
| 갭(Gap) 분석 | 현재 수준진단 자료을 통한 문제점 분석 |
| 제안서 제출 | 지도일수/일정/진행방향/비용/지불조건 등 |
| 계약서 체결 | 제안서 제출내용 검토,표준계약서 작성 |
| 계획 (Plan) | Kick off 미팅/추진조직 구성 | GMP 추진 TFT구성(총 책임자/ 실무 책임자/ 부서별 담당자 등) |
| 부서별 업무분장 | 할일에 대한 세부업무 분장 |
| 전체 GMP추진일정 계획수립 | 전체 추진 목표일정 계획수립 |
| 부분별 GMP수준 진단 | 각 부서별 세부 진행현황 및 수준파악 |
| 세부 할일 및 일정계획 수립 | 문제점에 대한 세부할일/주인/일정계획 수립 |
| 실행(Do) | 교육(부서별, 계층/수준별) | GMP개요, 기준서(설비관리/제조관리/제조위생/품질관리) |
| 시설/장비 및 기구보완(H/W) | 작업장 레이아웃 보완(인동선, 물동선, 청정도 등) |
| 제조지원 시스템(용수,공조,압축공기) 보완 |
| 필요한 기구 보완(측정기 구입 및 교정 포함) |
| GMP시스템 문서화(S/W) | 문서작성 방법 기본교육 |
| 사내 기준서 제/개정 |
| 사내 기준서 실행 |
| 각종 기준서의 기록서 작성 |
| 각종 표시사항 부착 | 각종 설비 및 배관(AIR, 용수 등) 표시라벨 부착(고유번호/종류/방향) |
| 평가(Check) | 시범 운영 및 보완 | 약 2~3주 간격으로 실제 GMP를 자율적으로 실행하여 문제점 파악/보완 |
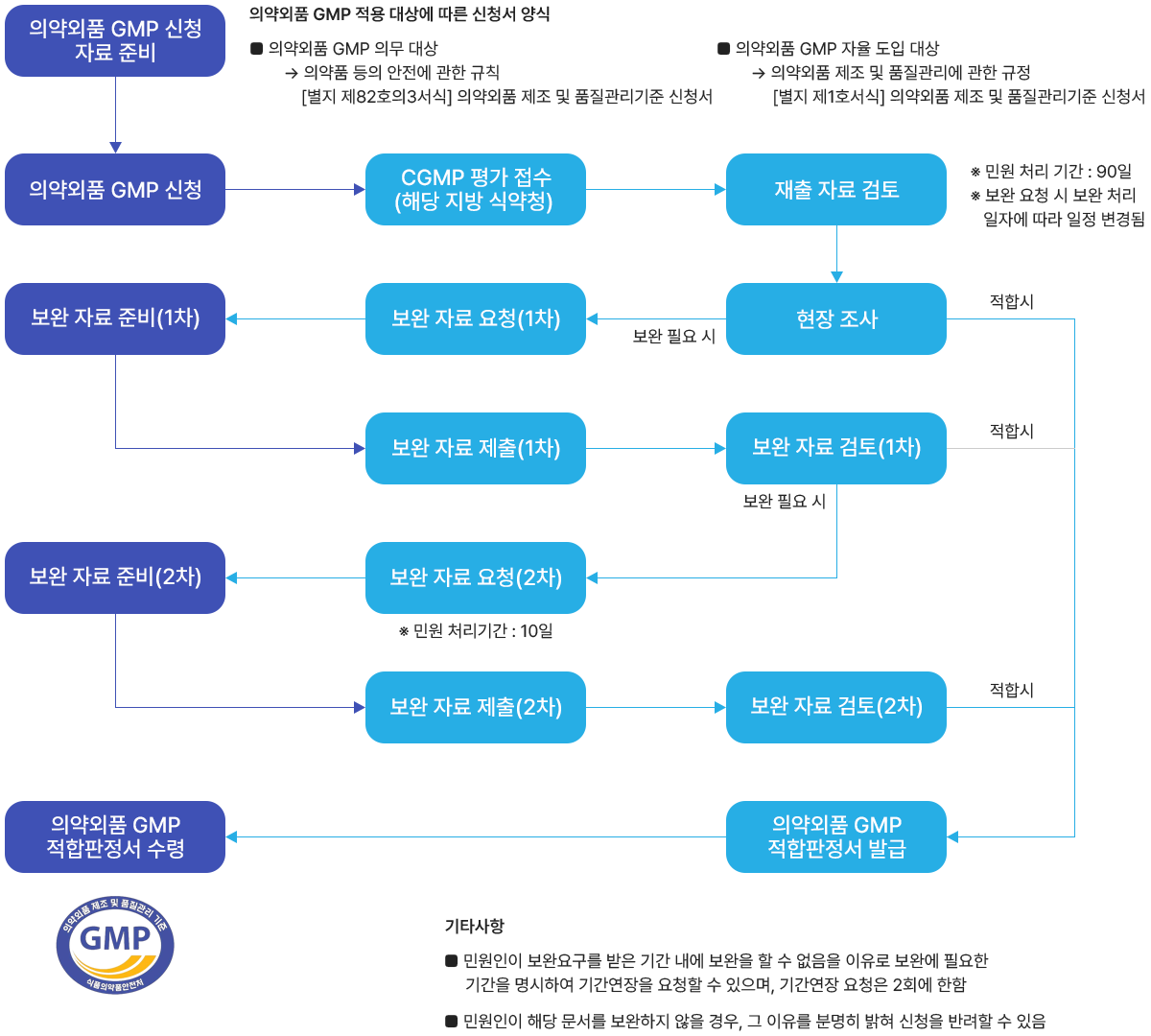
| GMP신청서 작성/제출 | 평가신청서 지적사항/ 보완 |
| 개선(Action) | 모의실사(자체) | 본실사는 6M/D 진행(예: 2인 시 3일, 3인 시 2일), (본청+지방청 직원) |
| GMP실사 | 식약처 실사 | 지적사항 사전 보완준비, 약 2주이내에 실사결과 문서로 통보됨 |
| 지적사항 보완/제출 | 지적사항 보완결과서를 제출(60일 이내), 2회 연장가능 |
| GMP승인 | 보완 완료후 7일이내 GMP승인 공문서 발송 |